Médicaments orphelins: un chemin ardu
Médicaments orphelins: un chemin ardu
MADRID / EFE / ANA SOTERAS mardi 28/02/2017
Les personnes touchées par des maladies rares qui n'ont pas regard de guérison avec l'espoir aux médicaments orphelins, certains médicaments destinés à une population très faible et dont les investissements dans la recherche et le développement ne compense pas l'industrie pharmaceutique, sinon pour les incitations qu'ils reçoivent. La Journée mondiale des maladies rares, dédié à la recherche, nous passons par le pénible voyage d'orphelin
drogue.Autres nouvelles
- Les patients atteints de maladies rares appellent à un fonds d'Etat pour leurs traitements
- Quels sont les produits biologiques?

En Espagne, plus de trois millions de personnes souffrent d'une des plus de 7500 maladies rares ou ultrarraras (ceux qui touchent moins de 5 à 10 000 personnes), mais seulement 6% ont un traitement spécifique.
Le Orphelins drogues. Ils visent à lutter contre ces maladies. Sur les 95 approuvé par l'Agence européenne des médicaments (EMA) depuis 2002, 53 ont été vendus jusqu'à présent en Espagne, selon les données Association espagnole des orphelins mis à jour en laboratoire et Ultrahuérfanos drogues (AELMHU).
Ce partenariat reflète qu'il ya une tendance à la baisse au cours des dernières années: dans la période 2002-2011 si les 42 médicaments orphelins approuvés en Europe, 38 ont été autorisés en Espagne (90,5%) dans la période 2012-2015, de 44 approuvé par la EMA, seulement 13 obtient le feu vert en Espagne (29,5%).
En ce qui concerne le temps écoulé depuis l'adoption par l'EMA à la commercialisation en Espagne passent en moyenne vingt mois.
En ce sens, la Fédération espagnole des maladies rares (Feder) assure qu'un médicament peut prendre jusqu'à deux ans pour atteindre les familles et le fait que chaque région est configuré en tant que système autonome fait tout aussi bien ont pas accès à ces médicaments, ils affirment que les critères d'accès et d'accélérer le processus de commercialisation.
AELMHU, qui rassemble plus d'une douzaine de sociétés pharmaceutiques et biotechnologiques dédiés au développement de thérapies innovantes ciblées pour les patients atteints de maladies rares et ultrarraras, un rapport de 2015 indique que « seul entre 5 000 à 10 000 molécules étudiées atteint enfin le marché « et ils passent entre 10 et 12 ans depuis la synthèse d'un médicament à la commercialisation.
L'investissement moyen pour un nouveau traitement est de 1100 millions d'euros.

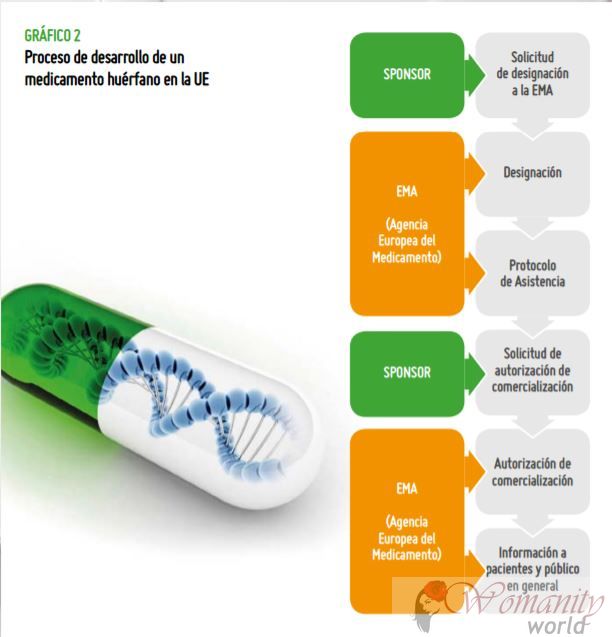
Les étapes des orphelins
drogues.Dans le processus de développement d'un médicament orphelin, il y a deux phases principales:
1. Le désignation est réalisée à la fois par l'EMA en Europe, et la Food and Drug Administration (FDA) aux États-Unis. Désignation indique qu'il existe des preuves que ce médicament peut être efficace que les tests précliniques. Dans l'EMA, dans ce cas, ils activent une aide ou d'incitation à poursuivre le développement clinique (tests sur les patients)
- Dix ans d'exclusivité dans l'UE après l'autorisation de mise sur le marché.
- sans avis scientifiques: le soutien de l'EMA sur différents tests et essais à réaliser pour démontrer la qualité, la sécurité et l'efficacité du médicament.
- Réduction ou exonération des droits dans la procédure.
- Promotion de la recherche: par les États membres de l'UE ou de financement.
2. Le Approbation Quand enfin le médicament montre l'efficacité, la qualité et la sécurité et est autorisé pour la commercialisation.
« Le problème est ce qu'ils appellent la Vallée de la Mort La période écoulée depuis la désignation de médicament orphelin reçoit jusqu'à ce qu'il atteigne le marché « , a déclaré Beatriz Gómez, chef de projet au Centre de recherche biomédicale Réseau sur les maladies rares (CIBERER).
Et à ce stade se trouvent généralement avec l'obstacle d'obtenir un financement, les procès publics ou privés, d'entreprendre des cliniques, qui peut durer plusieurs années.
Avec l'autorisation de commercialisation ne garantit que dans différents États patients d'accéder à la drogue depuis le processus de financement et de tarification se fait dans chaque pays.
Un guide pour les chercheurs

CIBERER et l'Agence espagnole des Médicaments et des produits de santé (AEMPS) a lancé un guide rapide pour aider les chercheurs dans le développement des médicaments orphelins démystifiant la complexité du processus.
CIBERER, qui promeut et coordonne les différents groupes de recherche avec des maladies rares projets à travers l'Espagne, travaille également pour le développement de nouvelles stratégies thérapeutiques.
En ce sens, ce centre de recherche a favorisé la mise en réseau et six désignés comme médicaments orphelins par l'EMA, trois d'entre eux aussi nommés par la FDA.
Ces trois médicaments de thérapie génique (technique qui remplace le gène muté par un autre droit sur les maladies génétiques rares) et d'autres 3 repositionnent médicaments déjà utilisés pour une autre maladie qui peut être utile pour certaines maladies rares. Dans ce dernier cas, le coût est inférieur à